摘要
现代杂交蛋鸡每年可产蛋300多枚,如果寿命较长可产蛋500多枚。如果蛋鸡无法持续排卵,这一目标则无法实现,而现代蛋鸡的祖先早已表现出这一性状。 新孵化母鸡的卵巢中拥有超过12000个卵母细胞。其中,只有一小部分会在未来获得卵黄,并发育成为成熟的排卵卵母细胞。性成熟后,不同大小的卵泡会由于脂质的积累而发育,从而形成一个卵泡层级体系,以确保每天只发育一个排卵前卵泡。对于卵泡选择的精确调控,人类了解并不深入,但能够确定垂体激素FSH和LH在这一过程中起到主导作用。与此相反,人类对于黄卵黄的形成已有非常全面的了解。
除免疫球蛋白外,所有蛋白质和脂类均在肝脏中合成,并通过血液流动转移至发育中的卵泡。卵黄中含有约36%的脂质、17%的蛋白质(主要是免疫球蛋白)以及少量游离碳水化合物和无机成分(-1%),其余的成分都是水。卵黄中的母源抗体均为IgY型。这些抗体由脾脏和其他淋巴器官中的B淋巴细胞产生,分泌至血液循环中,并在卵巢中通过主动转运的方式进入卵黄中。卵黄的形成在排卵前24小时完成。
近年来,蛋白质组学知识广泛应用于揭示参与不同卵膜、卵白和蛋壳形成的蛋白质,以及(已确定)可保护鸡蛋和胚胎免受病原体侵害的新型蛋白质的运作机制。此外,新的转录子数据有助于更好地了解鸡蛋形成的调控机制,但人们对这一机制的了解还很有限。
排卵后,卵泡位于输卵管漏斗部,1小时内将在此形成卵黄膜。 卵黄膜能够将卵黄与卵白分开,而卵白在随后的2至3小时内由输卵管膨大部的腺细胞和杯状细胞分泌形成。卵白中90%的干物质为蛋白质,完全由输卵管膨大部的细胞产生。随着胚胎进入输卵管峡部,蛋壳膜开始形成,随后在子宫内形成蛋壳。这一过程受排卵期和几种神经内分泌因子控制,这些因子可调节骨桥蛋白抗体的分泌以及钙转运蛋白和钙结合蛋白的表达。 在11至15小时内,蛋壳中会沉积2.0至2.5克钙。每天所需的钙有三分之二来自肠道吸收,其余三分之一则来源于名为髓质骨的独特骨结构。在蛋壳形成的间歇期,骨腔隙会得到恢复。与哺乳动物一样,钙离子平衡受到1,25-二羟基维生素D3和甲状旁腺激素的调节。
近年来,蛋白质组学知识广泛应用于揭示参与不同卵膜、卵白和蛋壳形成的蛋白质,以及(已确定)可保护鸡蛋和胚胎免受病原体侵害的新型蛋白质的运作机制。此外,新的转录子数据有助于更好地了解鸡蛋形成的调控机制,但人们对这一机制的了解还很有限。
关键词
鸡蛋、生产、蛋结构、卵巢、生殖道
引言
现代杂交蛋鸡每年可产蛋300多枚,如果寿命较长可产蛋500多枚。如果蛋鸡无法持续排卵,该目标则无法实现,而现代蛋鸡的祖先已经表现出这一性状(1)。新孵化母鸡的卵巢中拥有超过12000个卵母细胞。 其中,只有一小部分(250至500个)会在未来获得卵黄,并发育成为成熟的排卵卵泡,以形成鸡蛋(2)。在此,我将简要介绍鸡蛋在卵巢内和通过生殖道时主要结构的逐步发育过程。
卵泡的成熟
性成熟之后,不同大小的卵泡会由于脂质的积累而发育,从而形成一个层级体系,以确保每天只发育一个排卵前卵泡。 性成熟母鸡的卵巢皮质中蕴藏着许多原始卵泡,尺寸可达1毫米。这个静止的卵泡池会产生数量有限的初级卵泡,这些初级卵泡会进一步成熟形成所谓的分层前卵泡,而分层前卵泡每天只会有一个(排卵前卵泡)会形成最终的成熟卵泡(3)。对于这一选择过程的调节,人类的了解非常有限。据推测,抑制信号能够阻止脑垂体分泌的促卵泡激素(FSH)的受体表达。如果单个卵泡缺失这种抑制信号,会导致FSH受体的表达,以及FSH介导的类固醇激素的合成和支持卵泡相关细胞存活的因子的合成。 随后,FSH的作用减弱,黄体生成素(LH,另一种垂体激素)会对卵泡的成熟和卵黄的积累进行进一步调节。最初,原始卵泡聚集在皮质表面,最终通过卵泡柄与血液供应和神经系统产生相应的联系。从原始卵泡到初级卵泡再到分层前卵泡的成熟过程,与富含脂蛋白的白卵黄的积累有关。这种卵泡直径为6至8毫米,很容易在卵巢表面看到。 这些卵泡需要4至6天才能最终分化为排卵前卵泡,其特点是卵黄大量积累(每天2克),这一过程在排卵前24小时内完成(4)。卵黄构成
卵黄主要由脂肪(36%)、蛋白质(17%)和水组成;脂肪成分中,65至70%为三酰基甘油,25至31%为磷脂,4至5%为胆固醇。蛋白质成分包括α-卵黄球蛋白(14%;= 血清白蛋白)、β-卵黄球蛋白(41%;= 糖蛋白)和γ-卵黄球蛋白(45%;= IgY)。 碳水化合物、维生素和无机化合物在卵黄中的占比不到1%。卵黄特有的颜色是由类胡萝卜素,特别是叶黄素形成的 (2)。卵黄脂肪和卵黄蛋白都是在肝脏中合成的,这一过程是由卵巢中成熟卵泡分泌的雌激素和睾酮诱导的。脂肪成分在血液中以极低密度脂蛋白(VLDL)的形式转运。VLDL能够与一种名为LR8的特异性受体结合,这种受体在卵母细胞膜上高度表达,随后通过内吞作用进入卵黄中。对于这种受体已进行了详细的研究。除VLDL外,这种受体还可转运蛋白质和蛋白质相关的维生素。在母鸡体内观察到的LR8受体突变,可导致高脂血症和卵母细胞脂肪转移缺失,从而导致不孕(5)。免疫球蛋白Y(IgY)是唯一不在肝脏中合成的主要卵黄蛋白。 这种蛋白来源于淋巴组织中的浆细胞,而这种浆细胞是在免疫反应过程中由B淋巴细胞分化而来(6)。IgY可主动从血液中转移至卵母细胞中,这一过程由卵母细胞膜上的特异性受体介导。这种受体属于甘露糖受体家族,称为FcRY(7)。由于受体介导的转移,卵黄中的IgY成分能够精确反映血液中的IgY成分。卵黄中的IgY可达100毫克,可为发育中的胚胎和幼体提供母源抗体。此外,这种IgY还是诊断和治疗用抗体的丰富来源。
排卵
产蛋后15至60分钟,下一个成熟卵泡进行排卵。 因此,现代蛋鸡的排卵周期将近24小时,而低产蛋鸡的排卵周期可能长达27小时。排卵前4至6小时,排卵前卵泡分泌的黄体酮血液水平增加,从而诱发血液中的LH水平激增,促进排卵。对于卵泡气孔区域结缔组织的分解、卵泡壁的破裂和卵母细胞的释放,LH具有调节的作用。对于卵泡成熟、分层选择和排卵的整个过程,已均进行了详细研究,关于更全面的解释(包括调节网络的详细描述)请参见(2、4)。蛋鸡排卵率高的一个后果是容易形成卵巢肿瘤。对于超过2.5岁龄的母鸡,30%至35%会患上腺癌(8)。在商业条件下,蛋鸡通常很少会饲养至这一岁龄,所以较少发生卵巢癌。
鸡蛋在生殖道内形成
卵泡壁破裂导致卵细胞排出,输卵管漏斗部将卵细胞捕获,卵细胞经过漏斗部进入生殖道(图1)。 受精、卵黄膜和鸡蛋第一层卵白的形成,都在输卵管漏斗部中完成。大部分卵白是在通过输卵管膨大部时产生的,随后在输卵管峡部形成蛋壳膜。鸡蛋形成的最后一步,即鸡蛋壳的形成,是在子宫或蛋壳腺中完成的,然后鸡蛋才会通过产蛋的方式排出体外。 整个过程需要24至27个小时,其中大部分时间用于蛋壳的形成。鸡蛋的结构如图2所示。如前所述,产蛋后15至60分钟,下一次排卵就会发生。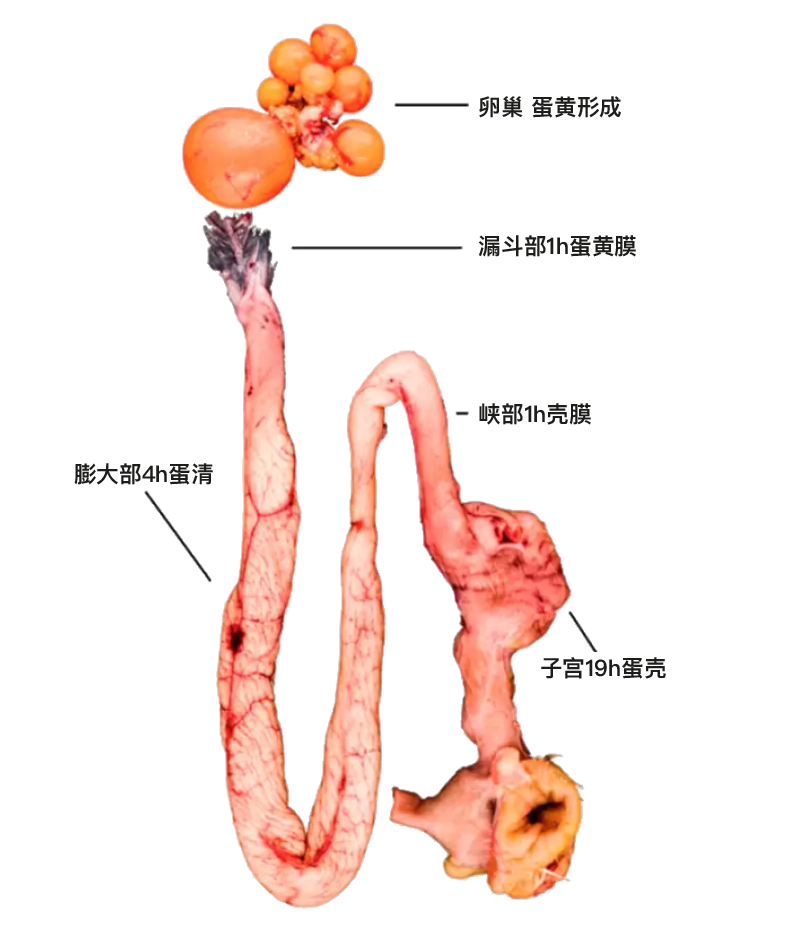
图1: 鸡的生殖道以及鸡蛋的逐步形成。
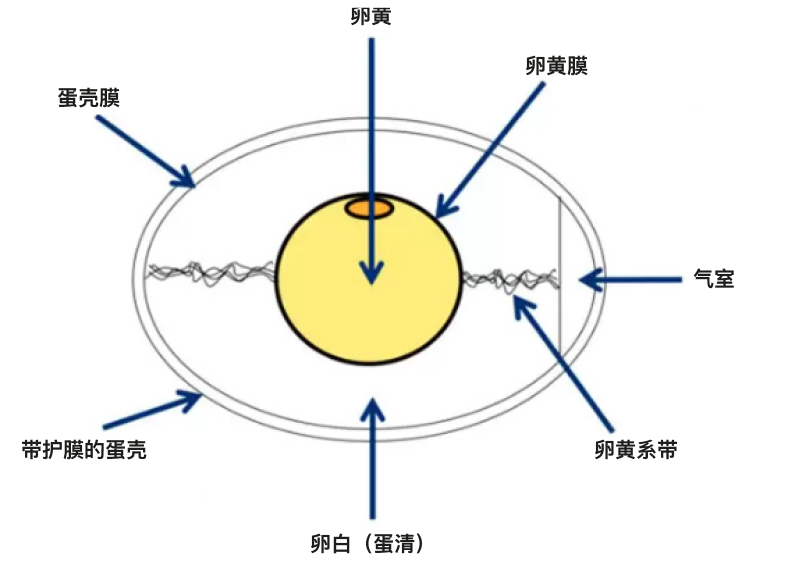
图2: 鸡蛋的结构。
漏斗部
卵细胞在输卵管漏斗部中的停留时间可达一小时。在此期间,会形成一层类似于哺乳动物透明带的膜,将卵细胞与卵白分开。 最近的研究表明,至少有137种蛋白质参与了卵黄膜的形成,其中大部分功能不明。不过,众所周知,输卵管漏斗部含有高浓度的抗菌肽(ß-防御素、溶菌酶、蛋白酶),从而形成了有效的内部屏障,以防止感染(9)。膨大部
卵细胞进入输卵管漏斗部后,在接下来的3至4小时内穿过输卵管膨大部,卵白在膨大部中形成。 卵白的主要成分是水,占比88%。干物质中90%为蛋白质,6%为矿物质,3.5%为游离葡萄糖。与卵黄蛋白不同,卵白蛋白不是在肝脏中产生的,而是由输卵管膨大部的粘膜产生的。管状腺会分泌卵白蛋白、卵铁传递蛋白、卵类粘蛋白和溶菌酶,而杯状细胞会提供卵粘蛋白和抗生物素蛋白。这些蛋白质的合成受到雌激素和黄体酮的调节,即使在没有形成鸡蛋的情况下也会继续合成。与此相反,当形成中的鸡蛋向下方的输卵管膨大部移动时,机械刺激会诱导预成形蛋白质的释放,这种释放与内分泌或神经元的调节无关。众所周知,由于多种肽(包括溶菌酶、抗生物素蛋白、胱蛋白酶抑制剂和几种防御素)的作用,卵白具有抗菌特性(10)。 与此同时,卵黄系带的形成过程很早就在输卵管漏斗部中开始了。卵黄系带由蛋白质纤维组成,连接卵黄和蛋壳膜,从而确保卵黄处于中心位置。由于形成中的鸡蛋向下方的输卵管膨大部移动时会旋转,纤维就会缠绕从而形成这种特有的结构。卵白并不是均质的,而是形成了粘度不同的区域,包括流动性较强的内层蛋清、浓蛋清和卵黄系带,以及流动性较强的外层蛋白。形成这种最终结构,是由于卵白在输卵管膨大部和子宫远端的水合程度越来越高,这一过程是由溶质分泌(钠、钙、镁和氯)和被动水运动介导的。
峡部
转入输卵管峡部后,蛋白纤维网开始形成内外蛋壳膜。 在鸡蛋的大部分区域这些蛋壳膜非常密集,但在钝端是分离的,以形成气室。虽然蛋清不能穿透蛋壳膜,但蛋壳膜允许水、气体(尤其是氧气)和矿物质进行交换。蛋壳膜的外表面会形成由蛋白质、碳水化合物和粘多糖组成的突起,称为乳突核。蛋壳正是在这些结构内开始形成。子宫(蛋壳腺)
鸡蛋进入子宫后,蛋清的水合作用会继续进行。水通过泵送作用经过蛋壳膜,导致体积增大,形成特有的卵圆形。 因此,形成中的鸡蛋与子宫壁紧密接触,从而有效地形成蛋壳。这一过程长达19个小时,其间会分泌一种由糖蛋白和粘多糖组成的有机基质,这种有机基质会钙化以形成蛋壳(11)。每个鸡蛋的钙化大约需要2至2.5克钙,这些钙会形成方解石晶体,这是一种高度稳定的碳酸钙(CaCO3)。结晶结构从乳突核向上生长,形成高度有序的壁垒,从而赋予蛋壳独特的强度。年产300枚蛋的蛋鸡需要近1.8千克的钙,这与其自身的体重相当。 如果饲料中的钙含量达到3.6至4%的建议水平,那么在蛋壳形成过程中所需的钙60至80%吸收自肠道。所需的其余20至40%钙来源于骨骼。钙的肠内吸收受到1,25-二羟基维生素D3的调节,而来自骨骼的钙动员则受到1,25-二羟基维生素D3和甲状旁腺激素(PTH)的控制。子宫排空后,从骨骼中动员的钙将得到补充,肠道吸收的钙可完全用于骨基质的形成。重要的是,母鸡会形成一种独特的骨基质,称为髓质骨。产蛋前两周,在雌激素和睾酮的控制下,长骨中出现了由相互连接的针状体组成的网状结构。这种结构最多可占骨钙总量的12%,但对于骨骼稳定性的支持作用却很小。然而,髓质骨的钙动员速度是皮质骨的10倍,因此能够迅速弥补肠道钙吸收的不足(4)。为了形成蛋壳,钙和碳酸氢盐(HCO3-)必须分泌到子宫腔内,以形成方解石晶体(CaCO3)。 子宫上皮细胞通过Ca2+通道从血液中吸收钙,并通过Ca2+结合蛋白(钙结合蛋白28K)将钙转移至顶端膜上,在这里钙通过主动泵送的方式进入子宫腔,以防形成浓度梯度。目前人类已了解几种Ca2+转运体,最近的蛋白质组学研究又揭示了一些新的潜在转运体(12)。
为了维持上皮细胞质中的低Ca2+浓度(对于细胞内分子稳定性至关重要),Ca2+不仅与钙结合蛋白结合,而且还会从活跃蛋壳形成过程中Ca2+快速释放的位置转运至细胞储存腔隙(内质网)。 HCO3-由细胞内的水和二氧化碳(CO2)生成,并通过一个能够分泌HCO3-而且在交换过程中吸收Cl-的转运体转移至子宫腔内。在子宫腔中,Ca2+和HCO3-与方解石晶体发生反应,以形成矿化的蛋壳基质。
产蛋前的最后一步是在卵壳上沉积一层蜡质薄膜,称为护膜。护膜由多糖、脂类和50多种蛋白质组成,其中许多蛋白质具有抗菌活性。因此,主要功能是防止微生物侵入鸡蛋,并限制鸡蛋中水分的流失(13)。
产蛋
这一过程通过子宫括约肌的放松和子宫平滑肌的收缩启动。受到神经垂体激素(主要是催产素和精氨酸催产素)以及生殖道内局部合成的前列腺素(例如PGF2α)的调节。在产蛋后的60分钟内,下一次排卵就会发生。结论
一个多世纪以来,人们一直在对鸡蛋的形态、构成和形成进行深入研究,并有大量文献可供查阅。然而,人们对许多调节路径仍然了解不足。新技术可能有助于深入了解鸡蛋形成的各个步骤以及卵黄、卵白、蛋壳膜和蛋壳的精确构成,例如新一代测序和蛋白质组学技术(12、14、15)。 反向遗传学在禽类生物学领域也取得了进展,最终将实现针对选定基因的体内功能研究(13)。

参考文献
1. Flock DK和Havenstein GB (2015年) 鸡蛋行业的需求驱动型生产效率:结合遗传学、健康管理和营养学领域的进展以满足不断变化的消费者偏好。《罗曼家禽育种公司情报资料》第49(1)期,第30至37页。2. Nys Y和Guyot N (2011年) 鸡蛋的形成与化学构成。《提高鸡蛋和鸡蛋制品的安全性与质量》,Nys Y、Bain M和Van Immerseel F版本(伍德海德出版社),第83至132页。
3. Johnson AL和Woods DC (2007年)卵巢动力学和卵泡发育。《繁殖生物学和鸟类系统发育学》,Jamieson BGM版本(科学出版社股份有限公司),第243至277页。
4. Johnson AL (2015年) 雌性的繁殖。Sturkie著《禽类生理学》,Scanes CG版本(爱思唯尔出版集团,阿姆斯特丹),第六版,第635至665页。
5. Nimpf J和Schneider WJ(1991年)蛋鸡体内的受体介导脂蛋白转运。《营养学期刊》第121(9)期:第1471至1474页。
6. Härtle S、Magor KE、Göbel TW、Davison F和Kaspers B(2014年)禽类免疫球蛋白的结构与演化。《禽类免疫学》,Schat K、Kaspers B和Kaiser P版本(爱思唯尔出版集团,阿姆斯特丹),第103至120页。
7. Tesar DB、Cheung EJ和Bjorkman PJ(2008年)鸡卵黄囊IgY受体(属于哺乳动物甘露糖受体家族)可实现IgY的跨极化上皮细胞穿胞转运。《细胞分子生物学》第19(4)期:第1587至1593页。
8. Johnson PA、Stephens CS和Giles JR (2015年) 家鸡:每天一个鸡蛋的原因和后果。《家禽科学》第94(4)期:第816至820页。
9. Mann K(2008年)鸡蛋卵黄膜的蛋白质组分析。《蛋白质组学》第8(11)期:第2322至2332页。
10. Etches RJ (1996年) 家禽的繁殖 (国际应用生物科学中心,沃灵福德)。
11. Nys Y、Hincke MT、Arias JL、Garcia-Ruiz JM和Solomon SE (1999年) 禽类蛋壳的矿化。《禽类和家禽生物学综述》第10期:第143至166页。
12. Jonchere V等(2010年)通过基因表达谱分析确定与鸡蛋物理抗病性因素有关的蛋壳蛋白。《BMC基因组学》第11期:第57页。
13. Schusser B等(2013年) 通过原始生殖细胞高效同源重组技术敲除鸡的免疫球蛋白。美国国家科学院院刊110(50):20170-20175.
14. Mann K和Mann M (2008年) 关于鸡蛋卵黄浆和颗粒的蛋白质组学特性。《蛋白质组学》第8(1)期:第178至191页。
15. Mann K和Mann M (2011年) 使用LTQ Orbitrap Velos质谱仪深入分析鸡蛋清蛋白质组学特性。《蛋白质组科学》第9(1)期:第7页。






