Aviadenovirus
Siadenovirus
Atadenovirus (voir Tableau 1).
Les hôtes naturels du virus EDS étaient à l’origine des oiseaux aquatiques, mais historiquement, le virus a été adapté aux poulets par des vaccins de Marek contaminés produits dans des cultures de fibroblastes d’embryons des canards dans les années 70 (EDS 76).
Infections par les adénovirus de la volaille (FAdV)

Seuls certains sérotypes ont été associés à des maladies chez les poulets. Au sein du genre Aviadenovirus, 5 espèces (A à D) ont été identifiées sur la base de la structure moléculaire, et 12 sérotypes basés en grande partie sur des tests de neutralisation croisée.
Comme il existe de grandes différences dans la nomenclature des souches FAdV entre les États-Unis et l’Europe, l’utilisation de la classification ICTV (Comité international sur la taxonomie des virus) est fortement recommandée.
Maladies cliniques associées à l’adénovirus des volailles
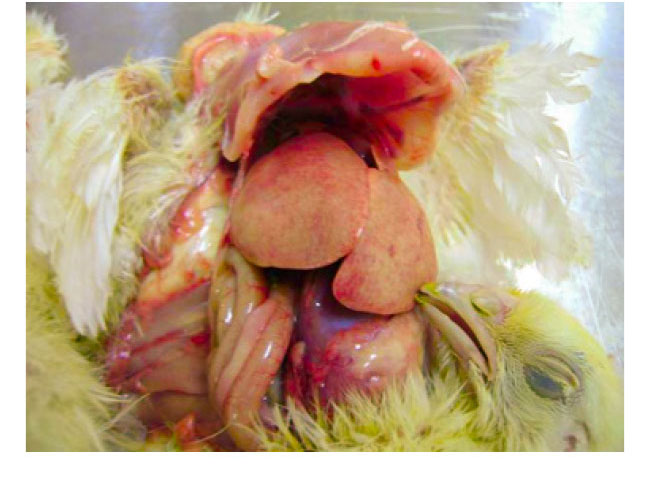
L’hépatite à corps
- L’hépatite à corps inclus a été signalée pour la première fois au début des années 70 aux États-Unis, puis dans de nombreux pays du monde (Australie, Nouvelle-Zélande, Europe).
- L’IBH est principalement causée par les espèces D et E du FAdV (sérotypes 2, 8 et 11).
- Les résultats pathologiques sont la congestion du foie, l’atrophie du thymus et des bourses.
- Les corps d’inclusion histopathologiques dans le foie sont prédominants.
- La maladie clinique est principalement observée chez les poulets de chair ou les reproducteurs de poulets de chair à l’âge de 7-18 jours de vie, ce qui indique une transmission verticale du virus dans la plupart des cas.
- La mortalité peut atteindre 10 à 40%.
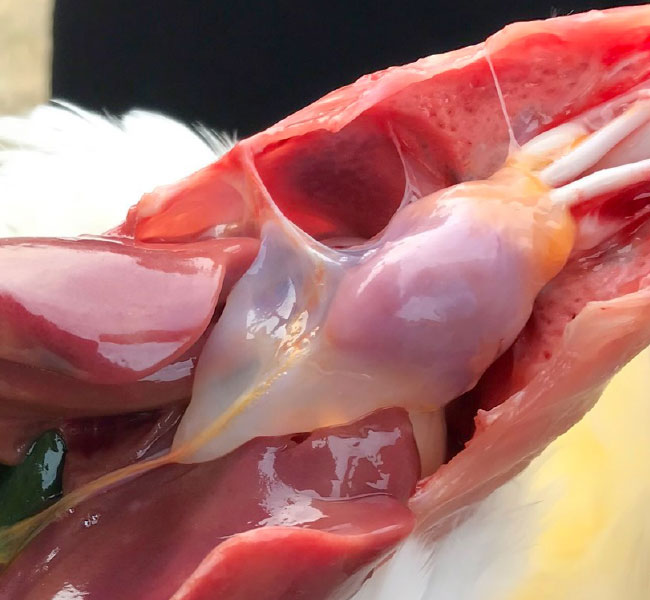
Le syndrome de l’hydropericarde
- Le syndrome de l’hydropericarde a été décrit pour la première fois au Pakistan en 1987 dans l’Angara Goth (“maladie angarienne”) et la maladie a ensuite été diagnostiquée en Inde, en Irak, au Koweït et en Amérique latine (Équateur, Pérou, Chili, Mexique). Le SPH est causé par les virus de sérotype 4 du FAdV. Les résultats pathologiques sont l’hydropéricarde, la congestion du foie avec des corps d’inclusion et l’atrophie du thymus.
- La maladie, observée principalement à l’âge de 3-5 semaines, est principalement causée par des infections horizontales, souvent associées à une immunosuppression sévère par d’autres infections comme les MICI ou les VAC ou par des mycotoxines.
- La mortalité peut atteindre 12-75% chez les poulets de chair et les poules pondeuses.
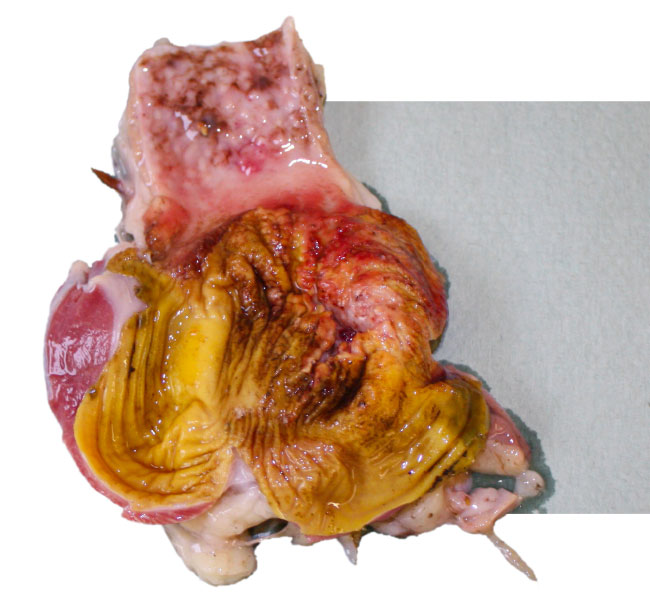
Érosions du gésier adénoviral (AGE)
- Les érosions du gésier ont été associées à une carence en vitamine B6 ou à l’ingestion d’histamine, de gézérosine et de mycotoxines. Les érosions gésiques adénovirales (AGE) ont été associées à des lésions gésiques dès 1981 et sont principalement causées par le sérotype 1 du FAdV.
- Les résultats pathologiques sont des érosions focales de la couche de koïtine du gésier, une inflammation de la muqueuse du gésier et une proventriculite. Des cas d’AGE ont été signalés chez les poulets de chair, mais ont également été observés occasionnellement chez les poulets pondeurs. La maladie clinique est rare car les lésions ne sont souvent visibles que lors de l’examen post-mortem ou au moment de l’abattage.
- La mortalité peut varier de 5 à 15 % à l’âge de 10 à 21 jours, ce qui suggère une transmission verticale du virus dans les premiers cas.
La détection des anticorps par la sérologie et l’identification des agents pathogènes par la virologie et la biologie moléculaire sont également des outils essentiels pour un diagnostic correct.

Différents tests de laboratoire sont disponibles pour la détection des anticorps contre le FAdV.
Ils diffèrent de ceux qui détectent les anticorps contre tous les sérotypes, comme le test de précipitation sur gélose spécifique au groupe et les tests ELISA, et le test de neutralisation du virus spécifique au sérotype (VN).
Le test d’immunofluorescence (IFT) peut détecter à la fois l’antigène et les anticorps.
Des kits de test ELISA expérimentaux et commerciaux sont fréquemment utilisés pour mesurer les titres d’anticorps du FAdV, mais ces tests ne peuvent pas différencier les anticorps contre les différents sérotypes du FAdV.
Le VN est un outil essentiel pour identifier le sérotype FAdV sur le terrain si des isolats de virus ne peuvent être obtenus. Le test VN est également recommandé pour surveiller la séro-réponse après la vaccination.
L’identification de l’agent pathogène par isolement du virus dans les cellules de foie d’embryon de poulet est limitée à des laboratoires spécifiques et utilise l’identification des effets cytopathiques spécifiques d’Adeno ainsi que la coloration des anticorps fluorescents ou des tests PCR ultérieurs.
De nos jours, les techniques de biologie moléculaire sont couramment utilisées car elles prennent moins de temps et ne nécessitent pas le recours à des techniques de culture de tissus. Les tests PCR suivis du séquençage de l’ADN ou de l’analyse de la courbe de fusion à haute résolution (HRM-) permettent non seulement de détecter mais aussi de sous-typer les agents pathogènes FAdV sur le terrain.
Les échantillons appropriés sont:
Prévention des infections par l’adénovirus des volailles
Les protocoles stricts de biosécurité chez les parentaux les troupeaux pendant la période d’élevage pourraient avoir un impact négatif sur la prévention des infections par l’adénovirus aviaire: plus les troupeaux d’éleveurs sont isolés pendant la période d’élevage, plus la probabilité d’une infection par l’adénovirus aviaire est élevée pendant la période de production, suivie d’une transmission verticale du virus dans une période de 4 à 6 semaines après l’exposition, jusqu’à ce que les éleveurs développent suffisamment d’anticorps pour empêcher la transmission verticale.
Alors que des vaccins inactivés sont disponibles pour le contrôle du syndrome de la goutte d’œuf, aucun vaccin commercialement autorisé n’est disponible pour les virus adéno de la volaille dans la plupart des régions du monde.
L’objectif de la vaccination est principalement la prévention de la transmission verticale et la protection des poussins d’un jour par les anticorps maternels.
Il est recommandé de vacciner les troupeaux reproducteurs deux fois au cours de la période d’élevage, à l’âge de 10-12 et 16-18 semaines.
Enfin, l’optimisation des performances des parentaux et de leur descendance est l’aspect le plus important de la protection vaccinale.







 Vétérinaire
Vétérinaire 


