 Linkedin
Linkedin

Aviadenovirus
Siadenovirus
Atadenovirus (см. Таблицу 1).

Изначально естественными хозяевами вируса ССЯ были водоплавающие птицы, но затем в семидесятых годах вирус адаптировался к курам посредством зараженных вакцин против болезни Марека, полученных с помощью культур фибробластов утиных эмбрионов (EDS 76).

Только определенные серотипы вызывают заболевания у кур. На основе молекулярной структуры было выделено 5 видов (A–D) рода Aviadenovirus; преимущественно на основе анализа перекрестной нейтрализации было выделено 12 серотипов.
Поскольку существуют большие различия между американской и европейской номенклатурой штаммов FAdV, настоятельно рекомендуется использовать классификацию ICTV (Международный комитет по таксономии вирусов).
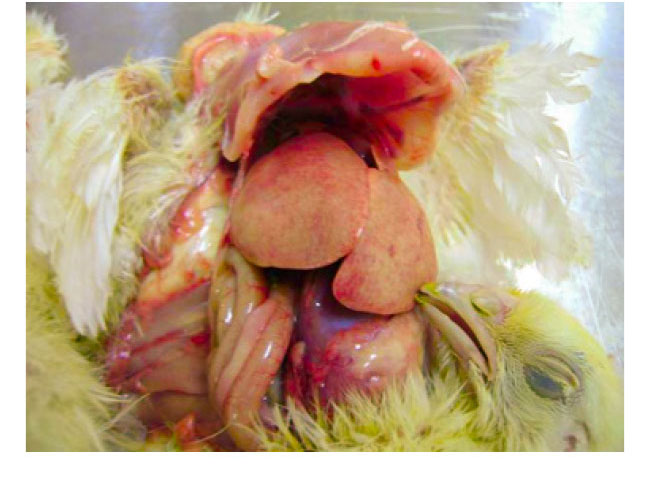
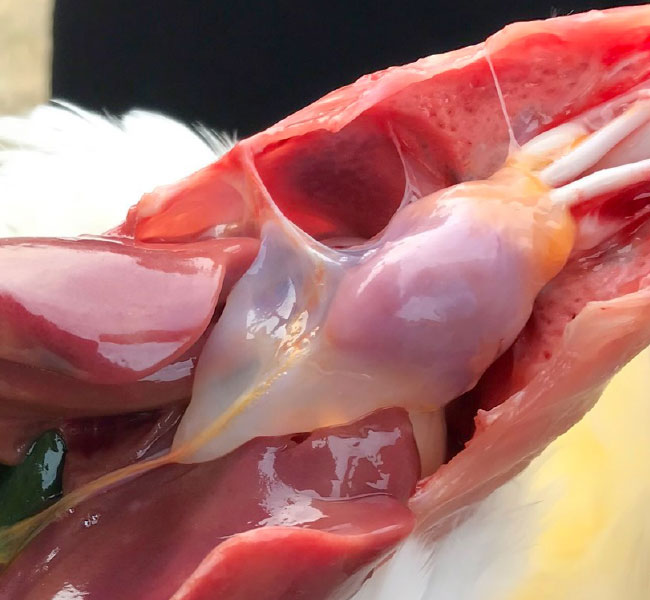
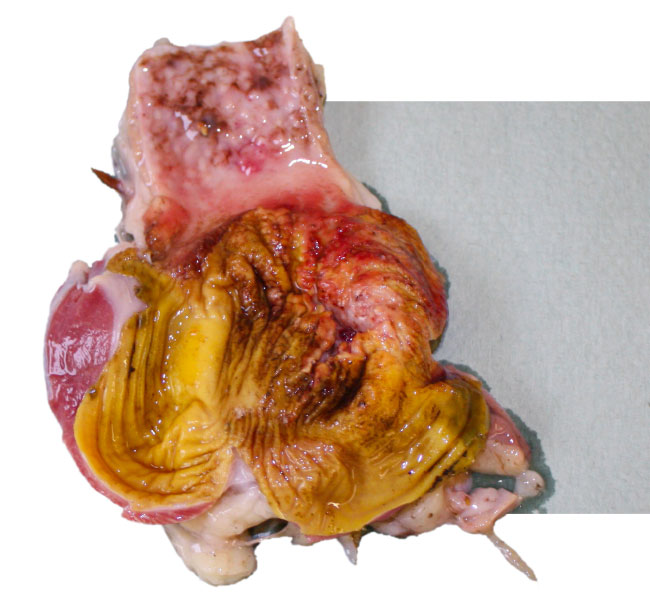
Для правильной диагностики также чрезвычайно важно использовать серологический метод выявления антител и определение возбудителей с помощью вирусологии и молекулярной биологии.

Для выявления антител к FAdV имеются различные лабораторные тесты.
Их делят на тесты, выявляющие антитела ко всем серотипам, как например, группоспецифический тест преципитации в агаровом геле, тест методом иммуноферментного анализа (ИФА) и тесты на нейтрализацию серотип специфического вируса (VN).
Иммунофлуоресцентный тест (IFT) может выявлять и антигены, и антитела.
Для измерения титров антител к FAdV часто используются лабораторные и промышленные тест-наборы ИФА, однако они не могут дифференцировать антитела к FAdV различных серотипов.
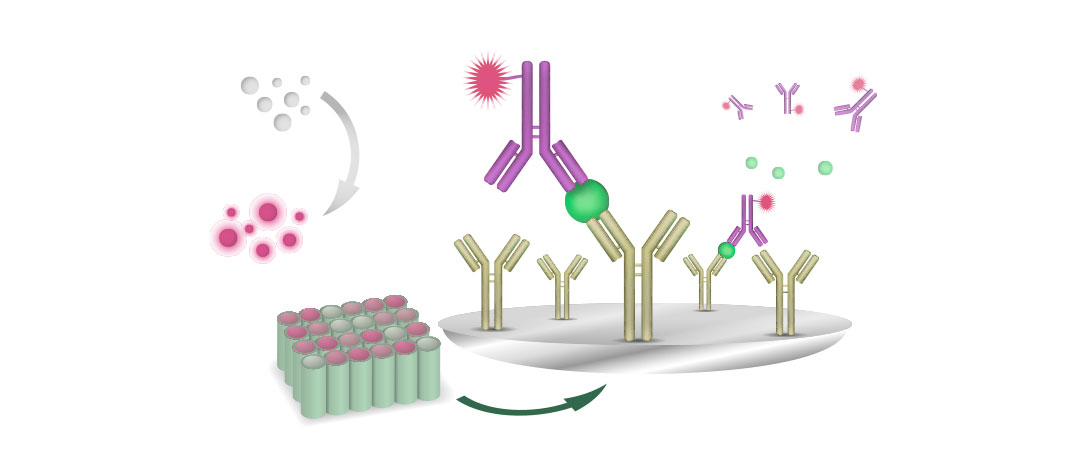
VN является важным инструментом для определения серотипа FAdV в полевых условиях, когда невозможно получить изоляты вируса. Тест VN также рекомендуется для контроля серологической реакции после вакцинации.

Определение возбудителя путем выделения вируса в клетках печени куриного эмбриона применяется только в некоторых лабораториях; при этом выявляют цитопатическое действие аденовирусов, проводят флуоресцентное окрашивание антител или последующее ПЦР-тестирование.
В настоящее время широко используются молекулярно-биологические методы, поскольку они требуют меньше времени и не включают методы культивирования тканей. ПЦР-тестирование с последующим секвенированием ДНК или высокоразрешающим анализом кривых плавления ДНК (HRM) позволяет не только обнаруживать, но и определять подтип патогенов FAdV в полевых условиях.
Для этого берут:
Строгие протоколы биобезопасности племенных стад в период выращивания ремонтного молодняка могут оказать негативное влияние на профилактику аденовирусных инфекций птиц: чем больше изолируют племенные стада в этот период, тем выше вероятность заражения FAdV в период продуктивности с последующей вертикальной передачей вируса в течение 4–6 недель после заражения, пока у племенной птицы не выработается достаточное количество антител для предотвращения вертикальной передачи вируса.
Хотя в продаже имеются инактивированные вакцины для борьбы с синдромом снижения яйценоскости, в большинстве стран мира отсутствуют лицензированные вакцины против аденовируса птиц, производимые в промышленных масштабах.
Целью вакцинации является в первую очередь предотвращение вертикальной передачи вируса и защита суточных цыплят с помощью материнских антител. В период выращивания ремонтного молодняка рекомендуется вакцинация племенного стада в два этапа: в возрасте 10–12 и 16–18 недель.

Please wait while flipbook is loading. For more related info, FAQs and issues please refer to DearFlip WordPress Flipbook Plugin Help documentation.